Nowe typy leków potrafią unicestwiać wrogie białka w naszych organizmach.
Maria Górna
Współczesna medycyna oferuje coraz nowocześniejsze, wysoko wyspecjalizowane leki po to, żeby działały już w małych dawkach i powodowały jak najmniej skutków ubocznych. Klasyczny lek to zwykle tzw. inhibitor, czyli mała cząsteczka, która wiąże się z docelowym białkiem, blokując jego działanie. Znalezienie lub zaprojektowanie takiego leku nie jest jednak prostym zadaniem. W ludzkiej komórce znajduje się kilkadziesiąt tysięcy różnych rodzajów białek, które odpowiadają za większość procesów zachodzących w naszym organizmie. Niektóre białka łączą się w struktury komórkowe, inne odpowiadają za rozpoznawanie lub transport metabolitów. Wiele z nich jest enzymami, czyli nanomaszynami przeprowadzającymi różnego rodzaju reakcje chemiczne, np. łączą, przekształcają czy rozkładają złożone związki.
W przebiegu wielu chorób niektóre białka działają niewłaściwie, zaburzając równowagę procesów zachodzących w komórce, np. powodując niekontrolowane mnożenie się komórek, co prowadzi do stanów nowotworowych. Idealny lek wyłączałby działanie jedynie wybranego białka, które źle działa, pozostawiając wszystkie inne w spokoju i oszczędzając zdrowe komórki.
Wszystkie białka są zakodowane przy użyciu tych samych 20 aminokwasów, dlatego odróżnienie wybranego białka od innych jest trudne. Na szczęście kolejność i dobór tych związków różni się w każdym łańcuchu białkowym, będącym sekwencją nawet tysięcy aminokwasów, co pozwala każdemu łańcuchowi zwinąć się w unikatową, z góry zaprogramowaną trójwymiarową strukturę. Są w niej obecne kieszonki i powierzchnie odpowiadające za oddziaływanie białek z innymi cząsteczkami (substratami, regulatorami czy innymi białkami).
Białka działają zwykle w większych układach i kaskadach. Życie na poziomie molekularnym jest zatem dynamiczną, trójwymiarową układanką, w której ważna jest koordynacja pracy różnych białek. Cząsteczka leku powinna być dopasowana przestrzennie do unikatowej kieszonki w strukturze docelowego białka tak jak zamek do klucza, wyłączając ten jeden wadliwy trybik z molekularnej maszynerii komórki.
Swatanie w trójwymiarze
Do sprawnego projektowania takiego „osobistego” leku klucza dla danego białka potrzebujemy wiedzieć, jak to białko wygląda w 3D. Średnia wielkość białka waha się od kilku do kilkunastu nanometrów, dlatego do obserwacji używa się krystalografii rentgenowskiej lub kriogenicznego mikroskopu elektronowego (najnowsza zdobycz techniki). Pod mikroskopem elektronowym są widoczne obrazy zamrożonych cząsteczek białka, z których komputerowo rekonstruuje się model 3D cząsteczki, co można zrobić również dla tzw. kompleksu białka z cząsteczką leku związaną w jego kieszonce. W ten sposób można ulepszać lek tak, by jak najlepiej pasował do kieszonki białka odpowiadającej za aktywność enzymatyczną i konkurował z jego naturalnym substratem, przez co będzie blokował działanie tego białka jako enzymu.
Kolejnym zadaniem w rozwoju leków jest upewnienie się, że ten sam lek nie będzie blokował działania innych niezbędnych białek, co powodowałoby toksyczne skutki uboczne. Z przeszłości słynny jest przykład talidomidu, leku podawanego w późnych latach 50. jako preparat uspokajający i przeciwwymiotny, zalecany dla kobiet w ciąży. Niestety, okazuje się, że talidomid w organizmie człowieka występuje w postaci racematu, czyli mieszaniny dwóch cząsteczek, R i S, będących swoim lustrzanym odbiciem. Podczas gdy odmiana R osiąga zamierzony efekt, odmiana S wiąże się z kilkoma białkami ważnymi dla rozwoju płodu i ma działanie teratogenne.
Skutki uboczne leków można również minimalizować przez aplikowanie ich tylko tam, gdzie zachodzi konieczność, czyli podając w docelowej chorej tkance lub namierzając docelowe białko.
Szacuje się, że w wyniku podawania talidomidu na świecie urodziło się około 10 tys. dzieci z wadami kończyn, z czego 40 proc. zmarło przy porodzie. Lek wycofano z rynku w 1961 roku. Kilka lat później odkryto, że talidomid i pokrewne mu imidy (łącznie nazywane IMiD – immunomodulatory imide drugs) mają działanie antyangiogenne i przeciwzapalne. Obecnie IMiD-y wróciły do łask w terapii niektórych nowotworów, chorób skórnych lub infekcji, przy czym dba się o to, by nie podawać ich pacjentom starającym się o dziecko.
Degradery
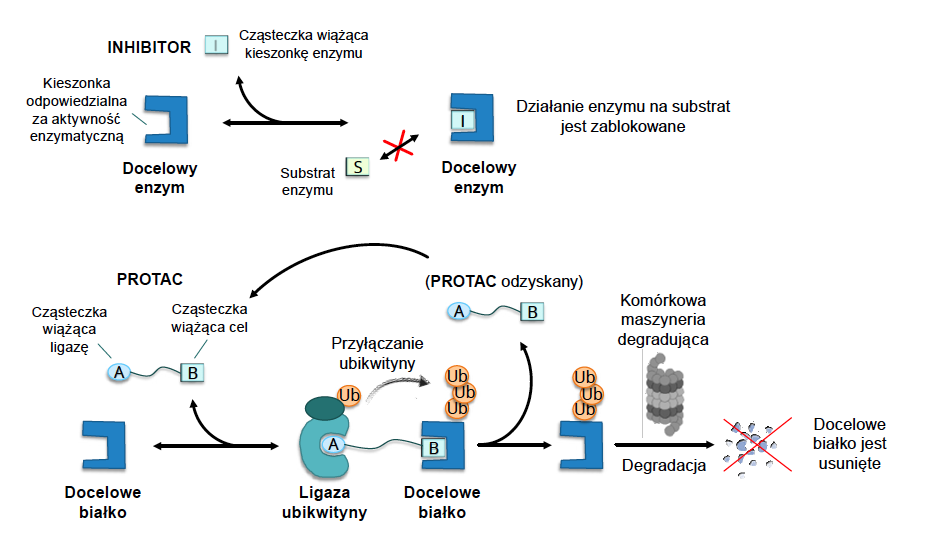
Skutki uboczne leków można również minimalizować przez aplikowanie leku tylko tam, gdzie zachodzi konieczność, czyli podając go w docelowej chorej tkance lub namierzając docelowe białko. Stąd większość obecnie rozwijanych leków ma budowę dwumodułową: jeden moduł odpowiada za namierzanie celu, drugi zaś za aktywność leku. Przykładem takiego typu nowoczesnego leku są chimeryczne (dwuczęściowe) cząsteczki PROTAC (proteolysis-targeting chimeras), które można wykorzystać do usuwania wybranego białka wewnątrz komórek.
PROTAC składają się z dwóch części: pierwszej cząsteczki, która wiąże się z docelowym białkiem, oraz przyłączonej drugiej cząsteczki, która wiąże tzw. ligazę ubikwityny. Ligaza ubikwityny jest naturalnie występującym w naszych komórkach enzymem, który przyłącza cząsteczki znacznika – ubikwityny – do wybranych, zwykle już niepotrzebnych komórce lub nieprawidłowych białek, co jest sygnałem do ich usunięcia przez pocięcie na kawałki (degradację). PROTAC tym samym należą do nowego fascynującego rodzaju leków: degraderów, czyli cząsteczek powodujących degradację proteolityczną docelowych białek.
Jest to zupełnie nowy sposób działania, gdyż pocięte białko jest nieodwracalnie usuwane z komórki, a tym samym jego aktywność ustaje raz na zawsze, podczas gdy tradycyjny inhibitor musi pozostać związany w kieszonce białka przez cały okres trwania białka, by blokować jego działanie. Cząsteczka PROTAC może z kolei po ligacji ubikwityny do jednej cząsteczki białka uwolnić ją i natychmiast zaatakować nową. I tak podczas gdy inhibitor musi przez cały czas „więzić” jedną cząsteczkę białka, PROTAC seryjnie wręcza kolejnym „karę śmierci”, co powoduje, że nawet mała dawka PROTAC jest dużo skuteczniejsza. Degradery działają na tyle szybko i skutecznie, że w niektórych przypadkach utrudniają ewolucję mutacji prowadzących do lekooporności w komórkach nowotworowych lub w genomie wirusa.
Dodatkowo, przez usuwanie całego białka degradery pozbywają się również jego innych, nieenzymatycznych aktywności, takich jak oddziaływanie z innymi białkami, które często również przyczyniają się do rozwoju choroby. Choć cząsteczka PROTAC nadal musi wpasować się przestrzennie w kieszonkę docelowego białka, nie musi to być kieszonka odpowiadająca za aktywność enzymatyczną – a więc celami działania tych leków nie muszą być enzymy.
Pierwsze leki PROTAC, które weszły do badań klinicznych w 2019 roku, były skierowane przeciwko receptorom hormonów steroidowych – białkom, które ze względu na brak aktywności enzymatycznej były wcześniej uważane za „nieuleczalne” (undruggable). Tymczasem PROTAC ARV-110, skierowany przeciwko receptorowi androgenowemu w raku, prostaty, i PROTAC ARV-471, skierowany przeciwko receptorowi estrogenowemu w raku piersi, już pokazały obiecujące wyniki i przeszły do następnej fazy badań klinicznych.
Co ciekawe, cząsteczka będąca składnikiem tych i wielu innych PROTAC to nic innego niż IMiD – po zbadaniu białek będących celem działania talidomidu okazało się, że móin. wiąże on dość rozpowszechnioną ligazę ubikwityny Cereblon. Zatem posiadanie dobrze scharakteryzowanej cząsteczki IMiD przyprowadzającej Cereblon do docelowego białka stało się kluczem do rozwoju kolejnych leków nowej generacji. Ze względu na zalety degraderów dziedzina rozwoju leków działających na zasadzie celowanej degradacji białek (targeted protein degradation – TPD) bardzo szybko się rozwinęła w ciągu ostatniej dekady.
Większość wielkich firm farmaceutycznych otworzyła własny program rozwoju degraderów, powstały także nowe firmy zajmujące się rozwojem tego typu leków, również w Polsce. Obecnie ponad 20 degraderów jest testowanych w badaniach klinicznych – zazwyczaj są to cząsteczki typu PROTAC lub pokrewne im tzw. kleje molekularne, nieco mniejsze od PROTAC cząsteczki, które „przyklejają” docelowe białko do ligazy ubikwityny. Cele ich działania obejmują nie tylko białka związane z nowotworami, lecz także z chorobami autoimmunologicznymi czy neurodegeneracyjnymi. Już niedługo będziemy mogli się cieszyć terapiami przyszłości zatrudniającymi wysoce wyspecjalizowanych molekularnych „zabójców” białek.
Oporne infekcje
Kolejnym frontem badań i rozwoju degraderów są zakażenia wirusowe i bakteryjne. Ponieważ degradery wywołują znacznie mniejszą lekooporność, tego typu leki byłyby bardzo pożądane w leczeniu zakażeń antybiotykoopornych. Ciągły wzrost oporności na środki przeciwdrobnoustrojowe doprowadził do globalnego kryzysu zdrowotnego, o czym donosiło również w listopadzie 2022 roku największe dotąd badanie opublikowane w „The Lancet”: już w 2019 roku infekcje bakteryjne były drugą najczęstszą przyczyną zgonów na świecie (zakażenie bakteryjne było przyczyną śmierci co 7ó–8. osoby).
Wśród dwóch najbardziej śmiercionośnych patogenów znalazły się Gram-dodatnia bakteria gronkowiec złocisty (powodująca ponad 1 mln zgonów w 2019 roku, wiodąca bakteryjna przyczyna śmierci w 135 krajach) oraz Gram-ujemna bakteria pałeczka okrężnicy (główna bakteryjna przyczyna śmierci w 37 krajach, zwłaszcza w Europie Środkowej i Wschodniej oraz Azji Środkowej). Ponadto od 2019 roku pandemia COVID-19 prawdopodobnie dodatkowo przyczyniła się do wzrostu stosowania antybiotyków i rozprzestrzeniania się oporności na te substancje.
Raport Światowej Organizacji Zdrowia z 2021 roku wykazał, że spośród 43 opracowywanych antybiotyków żaden nie dotyczył wielolekoopornych bakterii Gram-ujemnych, a tylko 2 z 11 antybiotyków zatwierdzonych od 2017 roku stanowiły nową klasę tych leków. Wskazuje to na pilną potrzebę opracowania nowych antybiotyków, zwłaszcza ukierunkowanych na patogeny Gram-ujemne i wykorzystujących nowy mechanizm działania. Dlatego też związki PROTAC, które już zrewolucjonizowały rozwój leków w dziedzinie chorób nowotworowych, mogą być doskonałą odpowiedzią na rosnące zapotrzebowanie na nowe antybiotyki. Niestety, technologia PROTAC wymaga znacznego dostosowania, by działała w bakteriach, gdyż posiadają one odmienny sposób kierowania białek do zniszczenia – w bakteriach nie występują ligazy ubikwityny.
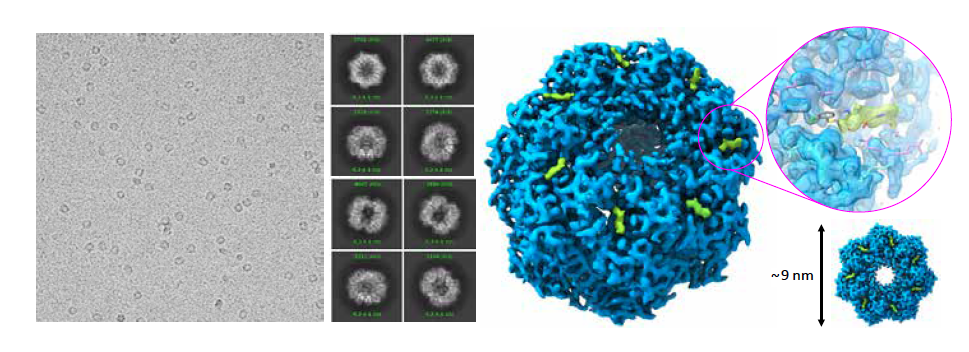
Niedawno pokazano pierwszy i jedyny znany skuteczny przykład cząsteczki PROTAC działającej na prątki gruźlicy. Prototyp BacPROTAC bazuje na cyklomarynie, cząsteczce, która z powodzeniem może przyprowadzać bakteryjną maszynerię niszczącą białka (jak IMiD ligazę Cereblon) – niestety, tę obecną tylko w prątkach. Zatem przyszłe PROTAC, które miałyby działać w pozostałych bakteriach, muszą zostać oparte na innej cząsteczce, którą dopiero trzeba opracować. Rozwojem bakteryjnych degraderów zajmuje się kilka laboratoriów na świecie, w tym Grupa Biologii Strukturalnej na Uniwersytecie Warszawskim. W tych badaniach jest wykorzystywana kriogeniczna mikroskopia elektronowa, żeby pomóc znaleźć i zaprojektować cząsteczki, które będą przyprowadzać docelowe białko bakteryjne prosto do maszynerii niszczącej białka występującej naturalnie wewnątrz bakterii.
Miejmy nadzieję, że za kilka lat będziemy testować pierwsze degradery działające również na groźne patogeny Gram-ujemne, choć na nowe superantybiotyki trzeba będzie jeszcze trochę poczekać. ■

